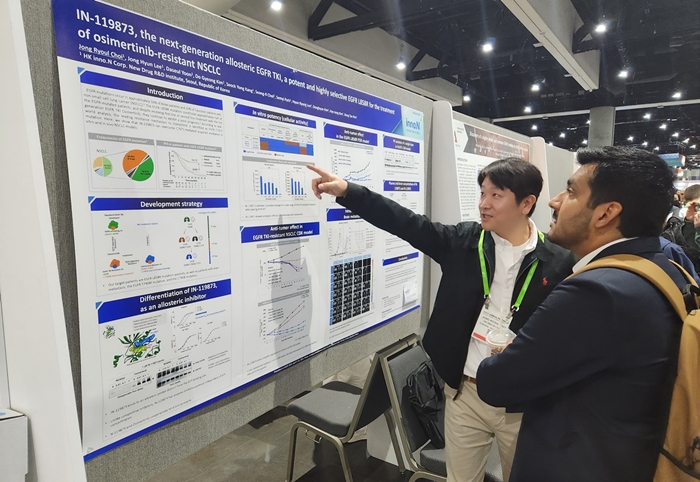
HK이노엔 미국암연구학회서 자사 폐암 연구 성과 소개
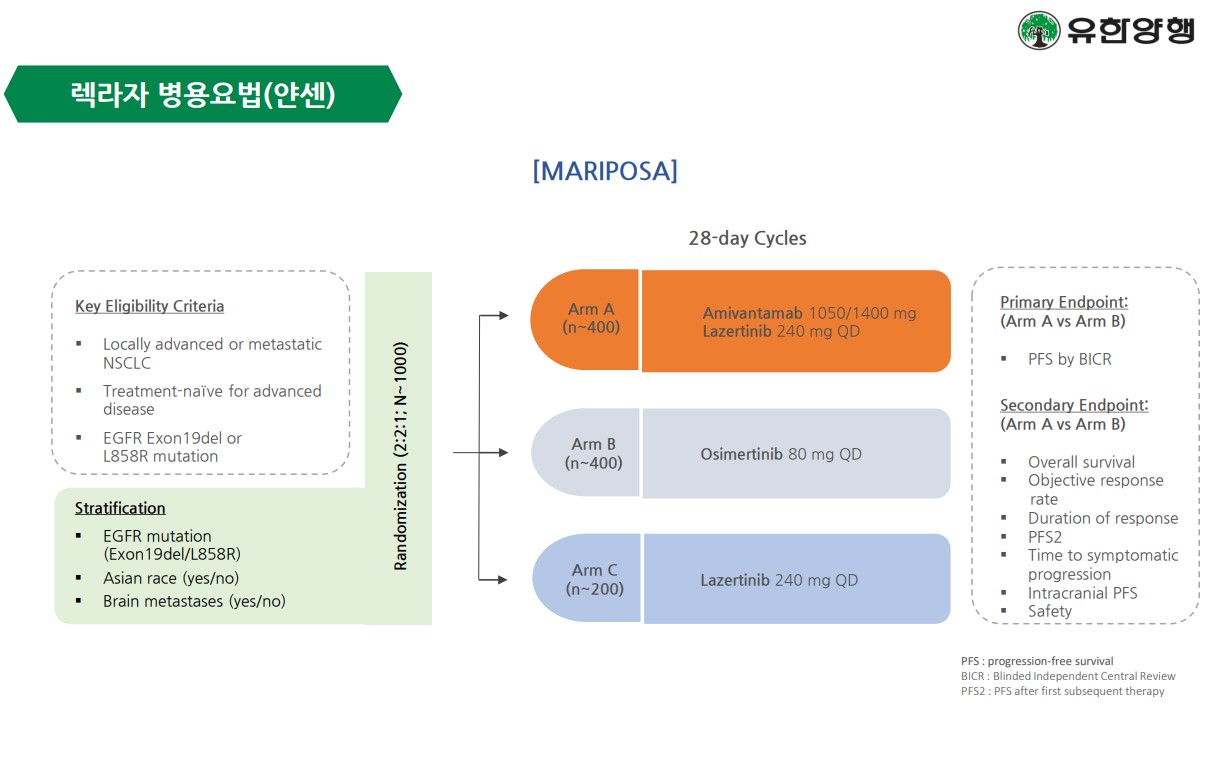
메디칼타임즈=허성규 기자HK이노엔(HK inno.N)이 지난 8일(현지시각) '미국암연구학회(AACR, American Association for Cancer Research) 2024'에서 차세대 알로스테릭 EGFR-티로신 키나아제 저해제(이하 'EGFR-TKI') 후보물질의 비임상 연구결과를 포스터 발표했다고 11일 전했다.HK이노엔은 지난 8일 미국 AACR서 차세대 알로스테릭 EGFR-티로신 키나아제 저해제 후보물질의 비임상 연구결과를 포스터 발표했다.HK이노엔이 발표한 효력 결과에 따르면 'IN-119873'은 L858R 변이를 포함한 주요 약물 저항성 EGFR 내성변이(T790M 및 C797S 이중변이 또는 삼중변이)에서 우수한 효력을 보였으며, 뇌전이 모델에서 역시 뛰어난 효력을 나타냈다.또한 'IN-119873'은 기존 3세대 EGFR-TKI인 오시머티닙과 병용 시 EGFR 변이에 더욱 강력한 결합력을 보였으며, 정상 EGFR에 대한 저해능이 거의 없어 기존 EGFR-TKI의 부작용을 최소화할 수 있다.EGFR 변이 비소세포폐암 환자 중 절반은 EGFR L858R 변이 환자이며, 이들은 기존 3세대 EGFR-TKI인 오시머티닙 투약 시 낮은 효능을 보이는 것으로 알려져 있다.HK이노엔의 'IN-119873'은 오시머티닙과의 병용요법을 통해 부작용은 줄이고, 효력은 보완할 수 있을 것으로 기대하고 있다.HK이노엔 신약연구소장 김봉태 상무는 "현재 개발 중인 'IN-119873'은 비임상 연구 완료 후 연내 임상1상 시험계획(IND)을 신청하는 것이 목표"라며, "향후 비소세포폐암 표준 치료제에 한계를 보이는 환자들에게 새로운 치료 옵션을 제공할 수 있을 것"이라고 말했다.HK이노엔은 기존 비소세포폐암 1차 치료제에 내성을 보이는 L858R 변이 환자를 위한 4세대 표적항암치료제 'IN-119873'을 연구하고 있다. 'IN-119873'은 암세포의 에너지원인 아데노신3인산(ATP) 결합부위를 공략하는 기존 치료제와 달리 상피세포 성장인자 수용체(EGFR)의 알로스테릭(단백질 자리 중 하나) 결합부위를 공략한다. 'IN-119873'은 기존 1, 2, 3세대 EGFR-TKI 약물로 발생한 EGFR 돌연변이에서 우수한 효능을 보일 뿐 아니라 3세대 EGFR-TKI와 병용 요법에서도 우수한 시너지를 보일 것으로 기대된다.